Лекція
ГІДРОЛІЗ СОЛЕЙ. ПОНЯТТЯ ПРО ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ ЯК
ХІМІЧНЕ ДЖЕРЕЛО ЕЛЕКТРИЧНОГО СТРУМУ
При вивченні властивостей органічних речовин
ви дізналися, що за певних умов жири, вуглеводи, білки зазнають гідролізу,
тобто взаємодіють з водою. Такі процеси відбуваються при нагріванні й наявності
кислоти або лугу, а в живих організмах – за участю ферментів. Під час гідролізу
жирів утворюються гліцерин і карбонові кислоти, сахароза за дії води
перетворюється на глюкозу і фруктозу, а кінцевими продуктами гідролізу білків є
амінокислоти:
білок → поліпептиди → дипептиди
→ амінокислоти.
1. Гідроліз
солей
Гідроліз солей відбувається в
гідратованих йонах, що утворюються під час розчинення солі у воді. Катіони
металічних елементів сполучаються з молекулами води ковалентним зв’язком за
донорно-акцепторним механізмом. Донором слугую атом Оксигену молекули води Н2О
з двома неподіленими парами електронів, а акцептором – катіон металічного
елемента, який має вільні орбіта лі. Аніони з’єднуються з молекулами води водневим
зв’язком.
У гідратних оболонках деяких
йонів за дії катіона чи аніона солі ковалентний зв'язок у молекулі води
руйнується. В одному випадку йон Н+, що утворюється при цьому,
сполучається з аніоном солі, а йон ОН- надходить у розчин. В іншому випадку
відбувається протилежне – йон ОН- з’єднується з катіоном солі, а в
розчині з’являється йон Н+.
Такою є суть гідролізу солей, унаслідок якого в розчинах виникає лужне або
кисле середовище.
Залежно від особливостей
гідролізу виокремлюють три типи солей (за їх походженням): І тип – солі, утворені сильною основою і слабкою кислотою,
наприклад, СН3СООNа(СН3СООН – слабка кислота, NаОН –
сильна основа), ІІ тип – солі, утворені слабкою основою
і сильною кислотою, наприклад, NH4Cl (NH4OH –
слабка основа, HCl – сильна кислота), ІІІ
тип – солі, утворені слабкою основою і слабкою кислотою, наприклад, СН3СООNН4
(СН3СООН – слабка кислота, NН4ОН – слабка основа).
2. Гідроліз
солей, утворених сильною основою і слабкою кислотою
Взаємодія з водою натрій ацетату
СН3 СООNa.
Водний розчин цієї солі містить йони Nа+ і СН3СОО-.
Частина ацетат-іонів СН3СОО- (вони походять від
слабкої кислоти) взаємодіє із молекулами води з утворенням молекул кислоти:
СН3СОО- + Н─ОН↔ СН3СООН
+ ОН-
Йони ОН- , що накопичуються в розчині натрій ацетату,
забарвлюють індикатор у відповідний колір. Отже, середовище розчинів таких
солей визначається сильним електролітом, від якого походить сіль. Розчин солі, утворений сильною основою і слабкою кислотою,
має лужне середовище (значення рН > 7).
З молекулярного рівняння гідролізу натрій ацетату
СН3СООNа + Н─ОН↔ СН3СООН + NаОН
випливає, що гідроліз солі можна класифікувати як реакцію
обміну між сіллю і водою.
Взаємодія натрій ацетату з водою є оборотною реакцією, оскільки серед реагентів
і продуктів наявні слабкі електроліти – вода і оцтова кислота СН3СООН. Відповідна хімічна рівновага зміщена
в бік утворення слабшого електроліту – води. Прямою реакцією є реакція
гідролізу, а зворотною – реакція нейтралізації. (Реакція нейтралізації –
реакція обміну між кислотою і основою, внаслідок якої утворюється сіль і вода.)
отже, в реакції гідролізу солей бере участь йон слабкого електроліту.
Гідроліз солей, які походять
від слабких двохосновних кислот
Сіль Nа2СО3 походить від слабкої двохосновної
карбонатної кислоти Н2СО3. Водний розчин цієї солі, як і
натрій ацетату СН3СООNа має лужне середовище.
Nа2СО3 = 2 Nа+ + СО32-
СО32- - йон слабкого електроліту, який утворюється внаслідок
дисоціації солі.
Саме він взаємодіє із молекулами
води:
СО32- + Н─ОН↔ НСО3- + ОН- (йонно-молекулярне рівняння)
Nа2СО3 + Н─ОН↔ NаНСО3 + NаОН (молекулярне рівняння).
Зверніть увагу: середня сіль перетворюється на кислу сіль, а не на
кислоту. Кислі солі, на відміну від середніх солей містять гідрогеновмісні аніони:
КНS, Ba(HSO4)2,
NaH2PO4.
Друга стадія гідролізу
практично не відбувається.
3. Гідроліз
солей, утворених слабкою основою і сильною кислотою
Взаємодія з водою амоній хлориду NH4Cl
Розчин сполуки містить катіони NH4+
і аніони Cl-.
Невелика частина йонів амонію NH4+ (вони походять від
слабкої амонійної основи) взаємодіють з молекулами води, а в розчині
з’являються йони Н+:
NH4+ + Н─ОН ↔ NH4ОН
+ Н+ (йонно-молекулярне
рівняння)
NH4Cl + Н─ОН ↔ NH4ОН + НCl (молекулярне рівняння).
Розчин солі, утворений слабкою основою і сильною
кислотою, має кисле середовище (значення рН < 7).
Гідроліз солей, які містять
дво- або тризарядні катіони металічних елементів
При взаємодії з водою таких
солей одним із продуктів реакції є так звана основна сіль. Ця сіль містить
гідроксокатіони крім катіонів металічного елемента.
Наприклад, гідроліз солі СuCl2:
СuCl2 = Сu2+ + 2Cl-
СuCl2 + Н─ОН ↔ СuОН+ +
Н+ (йонно-молекулярне
рівняння)
СuCl2 + Н─ОН ↔ Сu(ОН)Cl + НCl (молекулярне рівняння).
Друга стадія гідролізу
практично не відбувається.
4. Гідроліз
солей, утворених слабкими основою і кислотою
Розглянемо гідроліз солі такого типу на прикладі амоній ацетату СН3СООNН4.
СН3СОО-
+ NH4+ + Н─ОН↔ СН3СООН
+ NН4ОН (йонно-молекулярне
рівняння)
СН3СООNН4 + Н─ОН↔ СН3СООН + NН4ОН (молекулярне рівняння).
Водний розчин
амоній ацетату
Має
нейтральне середовище (рН = 7), оскільки ступінь дисоціації оцтової кислоти й
амонійної основи дуже малий і майже однаковий.
Залежно від
здатності до дисоціації слабких електролітів середовище
водних розчинів солей, утворених слабкими основою і кислотою, може бути
нейтральним, слабо лужним або слабо кислим.
Деякі солі, які походять від слабких
основи (амфотерного гідроксиду) і кислоти, зазнають повного і необоротного гідролізу:
Al2S3 + 6H2O =
2Al(OH)3↓ + 3H2S↑.
Зверніть увагу: в
таблиці розчинності клітинки таких солей містять знак #. Добути ці сполуки за реакціями обміну у водних
розчинах неможливо:
2AlCl3 +
3К2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6КCl
5.
Відношення до води солей, утворених сильною основою і
кислотою
Сполуки цього типу складаються з катіонів і аніонів, які не вступають у
хімічну реакцію з водою, тому вони не зазнають гідролізу. Водні розчини цих солей нейтральні.
Багато солей лише частково взаємодіють
з водою. Їх гідролізом зазвичай нехтують, здійснюючи різні реакції в розчинах.
6.
Вплив зовнішніх умов на
перебіг гідролізу
Оскільки гідроліз є, як правило, оборотним процесом, то чинники, що
впливають на стан хімічної рівноваги, діють і в разі взаємодії солі з водою.
Згідно з принципом Ле Шательє, додавання води (розбавляння розчину) або
підвищення температури зміщує рівновагу в бік прямої реакції – гідроліз солі
посилюється(це – ендотермічна реакція). І навпаки, гідроліз послабиться, якщо
додати в реакційну суміш один із його продуктів – кислоту або луг, а також
знизити температуру.
7.
Гідроліз солей у ґрунті
Малі кількості деяких солей містяться в ґрунтовому розчині. Їх гідроліз
незначною мірою впливає на рН ґрунту. Наприклад, солі Натрію та Калію, що
походять від органічних кислот, сприяють створенню слабко лужного середовища в
ґрунтовому розчині, а сульфати Алюмінію та Феруму дають свій внесок у
підкислення ґрунтів.
8.
Гальванічний елемент –
хімічне джерело електричного струму
Вам відомі реакції, які називають окисно-відновними. Під час їх перебігу
одні частинки втрачають електрони, а інші приєднують. До окисно-відновних
реакцій належать, зокрема, реакції металів із солями.
Якщо занурити цинкову пластинку в розчин купрум(ІІ) сульфату, почнеться
реакція
Zn + CuSO4 = Cu + ZnSO4.
Цинк поступово «розчинятиметься», а мідь осаджуватиметься на
пластинці, а можливо, й осипатиметься з неї на дно посудини. Про такі реакції
нерідко кажуть, що більш активний метал «витісняє» із солі менш активний.
Йонно- молекулярне рівняння цієї реакції:
Zn + Cu2+ = Cu + Zn2+.
Атоми Цинку виконують роль
відновника, віддають електрони й перетворюються на катіони (Zn – 2е- → Zn2+). Йони Купруму –
окисник; вони приєднують електрони й перетворюються на атоми (Cu2+ + 2е- → Cu).
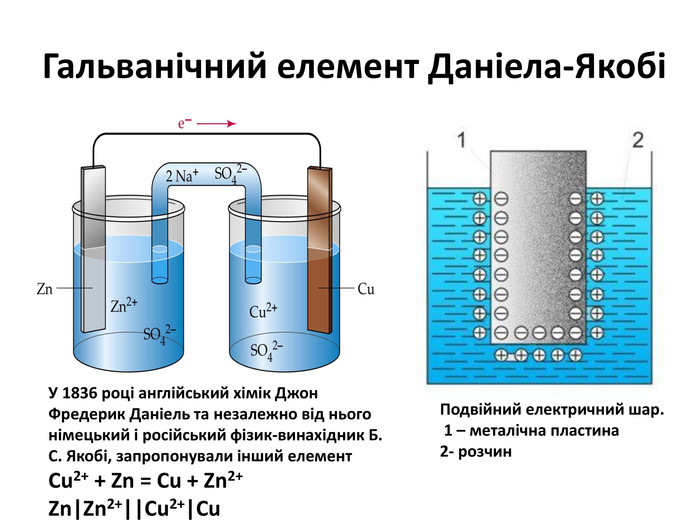
Англійський хімік Фредерік Деніел
спробував «роз’єднати» обидва процеси –
окиснення й відновлення. Він налив в одну посудину розчин цинк сульфату,
занурив у нього цинкову пластинку, а іншу посудину заповнив розчином купрум
(ІІ) сульфату і помістив у нього мідну пластинку. Потім учений з’єднав
пластинки дротиною, до якої приєднав гальванометр, а в обидва розчини помістив
зігнуту трубку(«електролітичний місток»), заповнену драглеподібною сумішшю, яка
містила розчин електроліту – солі лужного елементу. Гальванометр зафіксував появу
в дротині електричного струму: електрони від цинку рухалися до міді. Цинк
«розчинявся» в розчині цинк сульфату; атоми металу перетворювалися на катіони Zn2+. Маса мідної пластинки
зростала внаслідок перетворення
йонів Cu2+, які були в розчині купрум (ІІ) сульфату, на атоми
міді, які осаджувалися на пластинці.
Описаний пристрій отримав назву гальванічного
елемента. У ньому енергія хімічного перетворення (екзотермічної
окисно-відновної реакції) перетворювалася на електричну енергію. Гальванічний
елемент Даніела виробляв постійний електричний струм; на цинковій пластинці
(аноді) був негативний електричний заряд, а на мідній (катоді) – позитивний
заряд.
Пристрої, які
виробляють електричний струм унаслідок перебігу в них окисно-відновних реакцій,
називають хімічними джерелами струму.
Електролітний місток не
лише забезпечує електричний контакт між двома розчинами. Під час роботи
гальванічного елемента в розчині солі CuSO4 зменшується кількість
катіонів Cu2+, а в розчині солі ZnSO4 збільшується кількість
катіонів Zn2+. Цей місток підтримує електронейтральність
розчинів, постачаючи катіони Nа+ в розчин CuSO4 і аніони SO42- в розчин ZnSO4.
Якщо виготовити кілька гальванічних елементів, подібних до елемента
Даніела, з однаковими катодами
(наприклад, мідними), але різними анодами, то виявимо таку залежність:чим активнішим є метал анода, тим більшу
електричну напругу створює гальванічний елемент. Тому ряд активності
металів часто називають рядом напруг.
Зрозуміло, що використовувати елемент Даніела на практиці незручно. У
ХІХ ст. було винайдено так звані сухі
гальванічні елементи.вони містять не розчини, а пастоподібні (вологі)
суміші речовин.
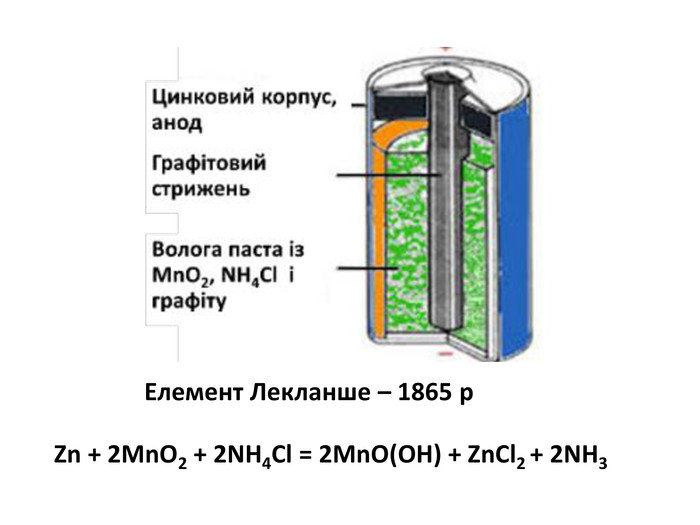
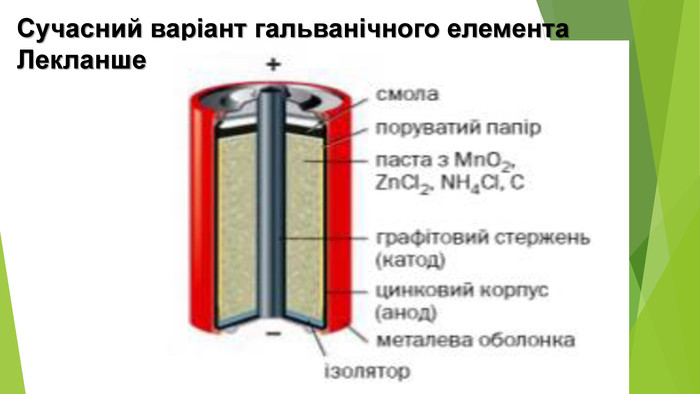
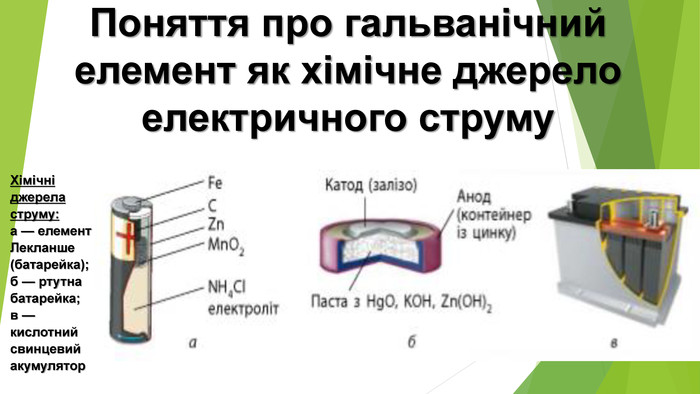
Найпоширенішим серед гальванічних елементів цього типу є манган-цинковий
елемент, вперше виготовлений французьким інженером Жоржем Лекланше у 1865 р.
його корпус зроблений із цинку, який виконує роль анода (це – негативний полюс
джерела струму). Усередині міститься волога паста з манган (ІV) оксиду МnО2,
цинк хлориду ZnCl2, амоній хлориду NH4Cl і графітового
порошку. В пасту занурений графітовий стержень, що є катодом (на ньому –
позитивний полюс). Гальванічний елемент герметизовано смолою.
Під час роботи цього хімічного
джерела струму відбуваються такі процеси. Цинк окиснюється: Zn – 2e- → Zn2+, унаслідок чого корпус
гальванічного елемента ізсередини поступово руйнується. На графіті
відновлюється Манган за спрощеною схемою
Мn+4 +
e- = Мn+3.
На плюсах елемента Лекланше
створюється напруга в 1,5 В. якщо послідовно зєднати кілька таких елементів (катод
першого елемента – з анодом другого, катод другого – з анодом третього і т.д.),
то утвориться батарея. Напруга на її полюсах дорівнюватиме сумі напруг
гальванічних елементів.
В останні десятиліття значного
попиту набули компактні хімічні джерела струму з тривалим періодом роботи.
Більшість із них мають цинкові аноди. У цинк-срібному гальванічному елементі
крім цинку, містяться арґентум (І) оксид
Ag2O і калій гідроксид КОН. Під час його роботи відбувається
окисно-відновна реакція
Zn +
Ag2O + 2КОН + H2O = К2[Zn(ОН)4]
+ 2Ag.
Батарейку можна використати
лише один раз. Існують хімічні джерела струму, які періодично заряджають від
електричної мережі й використовують знову. Це акумулятори. Вони є в мобільних
телефонах, ноутбуках, фотоапаратах, автомобілях.
Найпоширенішими є свинцеві, або
кислотні акумулятори. Їх робота ґрунтується на оборотній реакції
розряджання →
РbO2 + Рb + 2H2SO4 ↔ 2РbSO4 +
2H2O
заряджання ←
Деякі хімічні джерела струму, вироблені у другій половині ХХ ст.,
містили сполуки Кадмію, Меркурію, кількох інших елементів, які є токсичними. Нині
їх не випускають, а на сучасних батарейках можна побачити позначки «Сd – 0%», «Hg – 0%».
У звязку з інтенсивним застосуванням хімічних джерел струму набула
актуальності проблема їх утилізації. В багатьох країнах, у тому числі в Україні,
використані батарейки збирають; контейнери для них розміщують у супермаркетах,
закладах освіти. На спеціалізованих підприємствах із батарейок вилучають цинк,
деякі сполуки.
Висновок.
Гідроліз солі – реакція обміну
солі з водою з утворенням сполуки основного характеру і сполуки кислотного
характеру. З водою взаємодіють солі, які походять від слабких основ або/і
слабких кислот. Середовище водних розчинів солей може бути кислим, лужним або
нейтральним.
Гідроліз більшості солей –
оборотна реакція; хімічна рівновага зміщена ліворуч, у бік утворення води.
Завдання з дисципліни хімії для студентів 1 курсу з
теми
ГІДРОЛІЗ СОЛЕЙ. ПОНЯТТЯ ПРО ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ ЯК
ХІМІЧНЕ ДЖЕРЕЛО ЕЛЕКТРИЧНОГО СТРУМУ
Опрацюйте матеріал лекції, складіть конспект, виконайте наступні завдання
1.
У наведеному
переліку виберіть формули солей, що зазнають гідролізу: ВаСl2, KNO3, HCOONH4, Al2(SO4)3,
Na2SO3.
2.
Складіть молекулярні та йонно-молекулярні
рівняння гідролізу таких солей : а) барій ацетату, б)
плюмбум (ІІ) нітрату.
3.
Запишіть
замість крапок у йонно-молекулярних рівняннях формули відповідних йонів: а) Аl3+
+ Н─ОН ↔ … + …; б) РО43- + Н─ОН ↔ … + … .
4.
Складіть
по два молекулярних рівняння, які відповідають кожному йонно-молекулярному
рівнянню: а) F- + H2O ↔ HF + OH-; б) S2- + H2O ↔ HS + OH-.